
Conférence de Jonathan Julio, directeur général Medicatech lors des 19èmes Journées Nationales Suisses sur la Stérilisation, Bienne, 22 juin 2023
Depuis l'entrée en vigueur de l'ODim en 2021 et les deux aides-mémoires de Swissmedic qui se sont succédés en octobre 2022 et février 2023, Medicatech a eu beaucoup de questions se rapportant à la maintenance des dispositifs médicaux effectués par des tiers.
L'objectif de cet exposé était d'apporter une vision claire sur le cadre réglementaire car nous avons passé du temps au cours de ces derniers mois avec Swissmedic et des avocats spécialisés qui nous ont permis d'enrichir ce sujet et de vous donner une vision claire sur ce partage d'expérience.
L’ODim: le contexte européen avec une Suisse qui ne fait pas partie de l'Union européenne qui a ses particularités. En Suisse, le législateur a repris l'ensemble des exigences de la mdr dans l’ODim mais dans notre pays c'est uniquement l’ODim - et l’ODiv pour les in vitro - qui définissent l'ensemble des exigences applicables aux dispositifs médicaux y compris les exigences relatives à leur maintenance.
Précisons l’article 71 de l’ODim :
- Premier alinéa «Tout professionnel utilisant un dispositif veille à ce que sa maintenance et les tests de maintenance sont réalisées conformément aux exigences légales». Précisons «tout professionnel» il est question du personnel médical de l'établissement, donc cela peut être un responsable de la stérilisation, un responsable des dispositifs médicaux, ainsi que le service technique ou le bloc opératoire pour les plus petites structures. D’expérience cette tâche est essentiellement liée à la stérilisation.
- Alinéa 2 «La maintenance doit obéir aux principes d'un système de gestion de la qualité», c'est le mot clé, «et être organisé et documenté adéquatement». Cette qualité se démontre à travers une certification ISO 13485. Ensuite « elle se fonde sur deux aspects:
- a) les instructions du fabricant
- b) sur les risques inhérents au dispositif via son utilisation.»
Pour rappel tout organisation certifiée ISO 13485 a démontré qu'elle a une Analyse de risque cohérente puisqu'elle est, surtout en Suisse, hyper contrôlée par rapport à ce certificat. Dans ce cas, une entreprise tierce certifiée ISO 13485 a fait une analyse de risque sur les opérations de maintenance et de réparation, sinon elle ne serait pas certifiée.
Swissmedic a fait la même chose par rapport à son aide-mémoire qui consiste en des interlignes à cet article d’ODim. Il donne une définition de la maintenance: «on entend des mesures telles que l'entretien, les mises à jour logicielles, les inspections les réparations, la préparation à la première utilisation les retraitements en vue de réutiliser de maintenir ou de rétablir bon fonctionnement d'un dispositif.»
Elle indique aussi les exigences détaillées:
- «les mesures de maintenance doivent obéir à un principe de gestion de la qualité qui n'est pas en droit de modifier la nature des matériaux ou de changer sa destination opératoire par une modification.» Le principe du respect des instructions du fabricant, cela signifie que l’on respecte le cahier des charges du dispositif médical. Dans ce cas, si le réparateur tiers venait à procéder à une modification de ce dispositif médical, il deviendrait lui-même automatiquement fabricant selon la directive de l'ODim. La règle selon laquelle la maintenance se fonde sur les instructions du fabricant existe déjà. Swissmedic nous le rappelle dans l'aide-mémoire «responsable de la première mise sur le marché». Et le nouveau droit entré en vigueur le 26 mai 2021 dans l’ODim et le 26 mai 2022 dans l’ODiv «ne prévoit pas de changement par rapport à l'ancien droit et ne prévoit pas de règles plus restrictives concernant la personne apte à effectuer la maintenance celle-ci n'est dès lors pas exclusivement réservé aux fabricants». Donc la réglementation concernant la maintenance n'a absolument pas changé depuis 21 ans.
Ce fut donc une incompréhension sur le marché et nous avons eu le cas avec deux hôpitaux publics, dans deux cantons différents avec leurs services juridiques, qui avaient statué de manière opposée sur la même situation. Avec le même texte, il y a donc eu deux interprétations juridiques complètement divergentes. D'où le deuxième aide-mémoire Swissmedic qui est arrivé et qui a spécifié qu’aucune exclusivité de maintenance n’était possible, c’est-à-dire qu’elle n'est réservée à personne, ni au réparateur tiers, ni au fabricant ou à son représentant. - La maintenance se fonde sur les instructions du fabricant. Le fabricant du dispositif est à même de décrire comment la maintenance doit être effectuée. Ses instructions sont détaillées dans le mode d'emploi et les fabricants doivent communiquer la nature et la fréquence des mesures de maintenance. Ce sont des informations qui sont obligatoires et qui doivent être transmises.
- La dernière partie de la mémoire de Swissmedic parle du contrôle de la maintenance. C’est donc l'établissement hospitalier, la personne qui est responsable de la maintenance, doit contrôler que la maintenance qui est effectuée par le réparateur respecte les règles de l'ODim.
Deux moyens de contrôle existent:
a) Le premier en demandant le certificat ISO 13485 du réparateur; cela suffit car c'est un moyen de contrôle qui est totalement efficace et reconnue par Swissmedic puisque l'entreprise est certifiée par son système management de qualité.
b) Deuxième élément de contrôle qui peut être additionné, qui peut compléter la première ou la remplacer c'est au choix, c'est la liste de contrôle pour une inspection relative à la maintenance des dispositifs médicaux. Il s’agit d’une check-liste de 17 pages qui se fonde sur les exigences de la norme ISO 13485 et qui permet à la personne responsable de maintenance de l'hôpital d’auditer l'atelier de réparation et d’aller contrôler le réparateur tiers selon un canevas bien précis. Que ce soit le fabricant ou le réparateur tiers, c'est le même contrôle qui doit être effectué; ils sont sur le même pied d'égalité vis-à-vis des normes.
Une sélection de questions qui nous ont été posées
A. Comment contrôler la conformité du réparateur tiers?
Deux éléments: le certificat ISO 13485 dont la validité est généralement de trois ans. Le second, c’est la check-liste à disposition (voir ci-dessus), que nous vous recommandons de réaliser au moins une fois, et qui permet de voir un atelier de réparation de votre partenaire et, en même temps, de pouvoir passer en revue les différents éléments.
B. Est-ce que le CE du fabricant tombe en cas de réparation tierce?
Lorsque la maintenance est effectuée selon les indications du fabricant - cela veut dire respecter la forme du dispositif, les matériaux et sa destination opératoire -, dans ce cas-là le CE d'origine est toujours valable. Vu qu'une entreprise certifiée ISO 13-185 n'est pas en droit de modifier un dispositif médical, cela veut dire que vous êtes assuré.e qu’elle ne modifiera pas le dispositif médical.
C. La réparation ne peut plus avoir lieu sur l'électrochirurgie car c'est une classe critique IIB, par exemple le gainage des pincettes à coaguler?
Pour répondre à cette question, on parle de classes. Pour rappel, il y en a cinq (dont la nouvelle classe IR qui n'est pas encore mentionnée sur ce schéma).
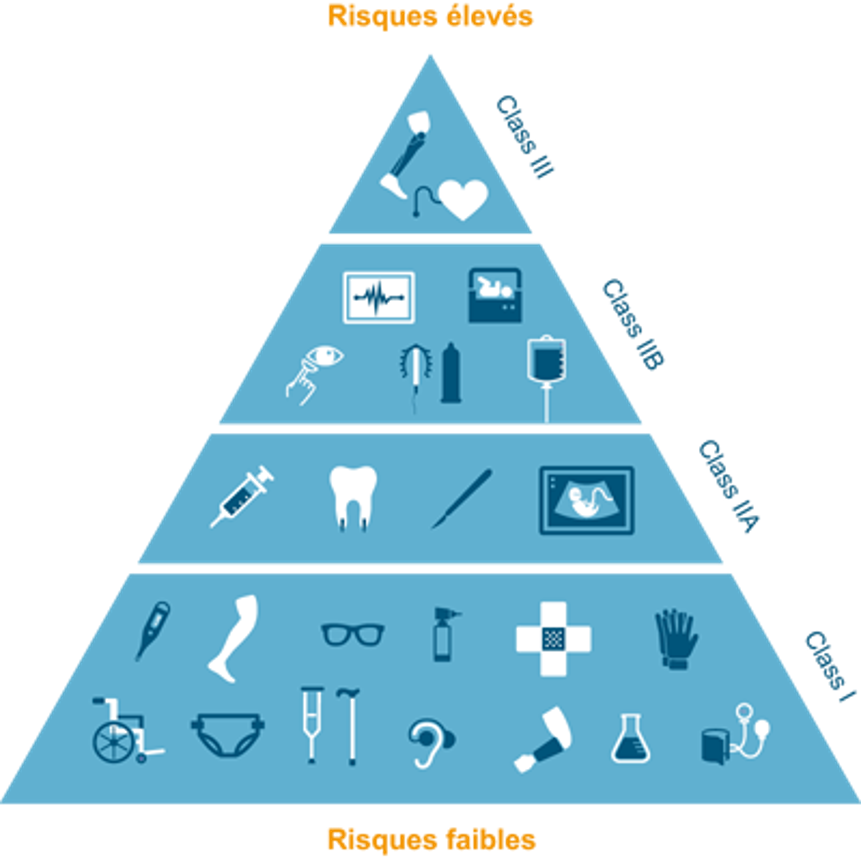
Et nous avons la réponse dans l’aide-mémoire de Swissmedic qui peut être résumé en une phrase «les règles de maintenance ne sont pas en lien avec les classes des dispositif médicaux». L'article 71 alinéa 2b indique bien que le système de qualité doit prévoir les risques inhérents au dispositif et à son utilisation. Il y a donc aucune limite de classe. La réparation par des tiers peut avoir lieu pour l'ensemble des dispositifs médicaux à condition que le risque du dispositif médical soit bien intégré dans le système qualité, ce qui est le cas dans une entreprise ISO 13845.
D. Il est spécifié dans la notice d’utilisation du fabricant que le DM ne peut être entretenu que par lui ou un réparateur agréé par la marque. Comme nous devons respecter les instructions du fabricant nous ne pouvons pas envoyer ce DM chez un réparateur tiers?

L’ODim est au niveau des ordonnances (3ème niveau). Les lois sont au-dessus et la LCart, loi contre les cartels, vient protéger les établissements hospitaliers sur le fait que l’on ne peut pas imposer un monopole commercial, donc exiger une maintenance exclusive. Swissmedic a donc précisé que l’exclusivité de maintenance n’existe pas.
C’est donc le propriétaire qui décide s’il veut faire réparer chez le fabricant ou le réparateur tiers. Donc une clause dans un contrat serait nulle selon la LCart.
Il faut faire la distinction entre les clauses techniques dans les notices, des informations indiscutables et obligatoires, et des clauses déguisées en techniques commerciales.
E. Est-ce je perds la garantie du DM si e l’envoie chez un réparateur tiers?
La pyramide du droit (ci-dessus) nous permet justement de répondre à cette question puisque ce n'est pas l’ODim qui va gérer la notion de garantie, car nous sommes dans le Code des obligations qui protège le propriétaire. Donc au niveau du CO (367ss CO), le DM sera sous garantie, soit chez le fabricant, soit par le réparateur tiers.
En conclusion
4 points à retenir:
- Le réparateur tiers n'a pas besoin d'autorisations de la part des fabricants;
- Il n'y a pas de limite de classe critique tant que la gestion qualité ou le système management qualité est conforme à l'article 71, Si ce réparateur est certifié ISO 13485, dans ce cas-là il est certifié;
- Les dispositifs médicaux restent sous garantie soit chez le fabricant ou chez une réparateur; dans les faits la dernière personne qui l'a touché;
- L'établissement doit contrôler que la maintenance est effectuée selon les normes légales donc en demandant le certificat ISO 13485 au réparateur ou en inspectant le réparateur en s'appuyant sur la check-list que Swissmedic met à disposition.
En savoir plus
Jonathan Julio se tient à votre disposition pour évoquer les sujets de cette conférence.
Utilisez notre formulaire de contact. Vous pouvez nous joindre au 021 800 42 55.
